中國制藥赴美斬獲38仿制品種 恒瑞、華海等哪家強?
加入日期:2018/2/26 9:19:39 查看人數: 1133 作者:admin
醫藥網2月26日訊 縱觀整個2017年,來自中國的制藥企業共在美國斬獲38個ANDA申請文號,其中包括31個正式文號、7個暫時性批準文號。在優先審評以及一致性評價等政策的引導之下,海外認證品種的國內價值正日益凸顯。制劑國際化力量增厚的同時,ANDA的獲批也在更大程度上為企業帶來國內真金白銀市場的話語爭奪權。
相較于2016年8家中國制藥企業在美國收獲22個ANDA批件而言,2017年31個ANDA正式文號、7個暫時性批準文號的戰果,似乎在彰顯著中國制藥軍團進軍國際市場的水平已又高一籌。
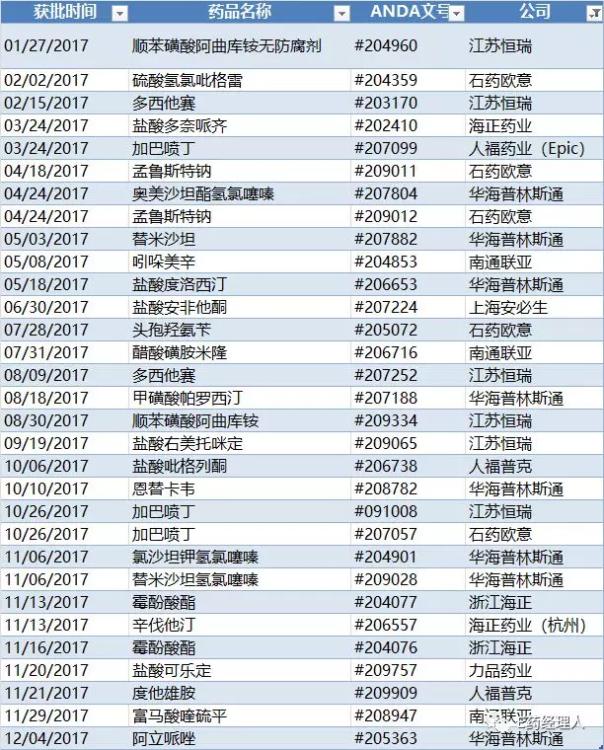
2017在美獲得ANDA情況一覽
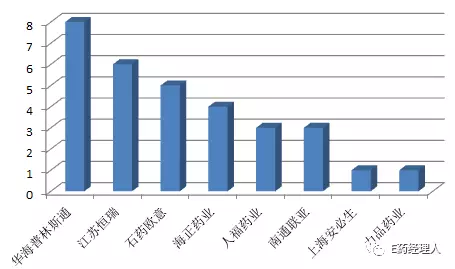
具體來看,2017年在美國取得ANDA正式批準文號的仍然是八家公司,按照獲批數量由多至少,依次是華海普林斯通(8個)、江蘇恒瑞(6個)、石藥歐意(5個)、海正藥業(4個)、人福藥業(3個)、南通聯亞(3個)、上海安必生(1個)、力品藥業(1個)。
而取得暫時性批準文號的則涌現出一些新鮮面孔,如瑞陽制藥的枸緣酸西地那非、海正宣泰的鹽酸二甲雙胍、華仁藥業的纈沙坦氫氨噻嗪以及楊凌步長藥業的他達拉非。
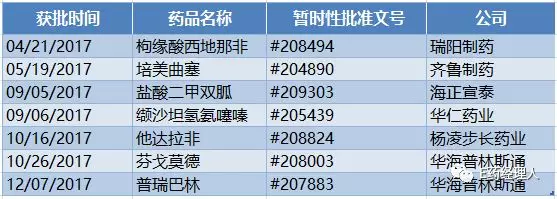
2017年ANDA暫時性批準一覽
華海藥業:穩居榜首
在所有上榜企業中,一馬當先的仍然是華海藥業。作為國內首家通過FDA認證的制劑企業以及得到國際認證最多的制劑企業之一,華海藥業近年來在制劑出口以及國際化發展領域儼然已經打出了自己的招牌形象。根據上市公司公告統計,自2007年以來,除2009年一年出現空檔之外,每年華海藥業都有相應的品種在美國獲批,且數量近年來基本呈逐年增加的態勢,2016年其共有6個品種獲批,而2017年則達到歷史最高,算上暫時性批準的兩個產品,華海一共有10個產品在2017年獲批ANDA。
而在所有這些產品中,最值得關注的是2017年8月獲批的帕羅西汀膠囊,這是中國第一個專利挑戰成功的品種。此前,華海子公司普林斯通與Actavis兩家公司均就該產品對帕羅西汀膠囊的原研公司Noven提出了專利挑戰,最終華海率先挑戰成功。
要知道,這對于華海來說絕對是一件意義非凡的事情。想要成為一流仿制藥企業,構建起一個架構完整的專利挑戰體系與良好的專利訴訟體系是一件必須的事情,據悉,目前華海上百個仿制藥項目至少涉及40個專利挑戰項目,而一旦專利挑戰成功,無疑就意味著搶占市場的能力進一步增強。帕羅西汀膠囊的成功獲批就證明了這一點。
而另外一個值得關注的則是力品藥業(廈門)獲批的鹽酸可樂定緩釋片。這款藥是由華海美國與力品藥業共同投資、力品藥業負責產品開發的品種。近年來,技術難度更高的緩釋劑型已經成為了華海重點攻克的方向,目前從2013年至今也已有5個緩釋劑型獲批。
據西南證券測算,華海藥業此次獲批的11個品種(包括與力品藥業共同開發的鹽酸可樂定緩釋片)于2016年在美國市場的銷售總金額為92.28億美元,如果按照平均10%的市占率測算,在美國的峰值銷售將達到9.2億元。如果按照出廠價為終端售價的20%、凈利率為15%進行測算,則將預計給華海帶來12.0億元的收入增量預計1.8億元的利潤增量。
恒瑞醫藥:厚積薄發
盡管相對于華海藥業來說,恒瑞醫藥2017年6個ANDA似乎不足為道,但對于恒瑞醫藥自身而言,這絕對是一個爆發。要知道,自2011年恒瑞醫藥第一個ANDA鹽酸伊立替康獲批開始算起,到2017年之前,恒瑞醫藥也一共只有5個ANDA獲得了批準。
仍然同此前的特點一樣,此次獲批的6個ANDA中,有5個都是注射劑,這跟恒瑞醫藥制劑國際化的戰略有關,一直以來恒瑞都將視線集中在注射劑等工藝復雜、技術難度較高的領域,以及抗腫瘤、手術麻醉等市場容量極大的領域,此前獲批的5個ADNA之中,也有3個都是注射劑。也正因此盡管數量相對較少,但幾乎恒瑞醫藥獲批的產品都是能帶來大量利潤的重磅產品。
而在國際化與創新并重的戰略之下,國際市場也已經成為恒瑞越來越重要的發展動力之一。恒瑞此前便表示,將會加快推進海外市場,力爭未來幾年內使所有主力品種全部通過美國FDA或歐盟認證,為開拓海外市場打基礎。
石藥歐意:躍升黑馬
實際上,除了華海普林斯通之外,人福醫藥以及南通聯亞的出現都不足為奇。已經順利完成收購的美國仿制藥Epic已經開始為人福醫藥貢獻ANDA,而人福普克2017年也順利拿下兩個ANDA批文。南通聯亞作為始終以歐美高端市場為主的非專利藥研發和生產企業,近年來也是在美國FDA利好消息不斷,尤其是去年在國內也有步長制藥就硝苯地平控釋片、鹽酸二甲雙胍控釋片等5款藥物達成了長期合作,其發展態勢也可見一斑。
令人驚喜的是石藥歐意在過去一年ANDA方面的表現。早在2016年,石藥歐意 就已經拿下了鹽酸二甲雙胍片的ANDA,而在CDE于2017年4月13日發布的第15批優先審評名單中,該藥赫然在列,其被納入優先審評的理由則為“同一生產線,已在美國上市,申請國內上市的仿制藥”,而這時CDE首次以此理由將相關品種納入優先審評名單。而在2017年,石藥歐意則又拿下五個ANDA文號,其中包括硫酸氫氯吡格雷這樣市場表現良好的品種,對于石藥集團而言,這無疑是個好消息。
海外制劑回歸國內
盡管對于制藥企業而言,能否通過FDA認證以及ANDA品種數量的多少,在很大程度上代表了企業的國際市場競爭力與影響力,但在如今的政策環境下,必須看到的一點是,海外認證品種的國內價值正日益凸顯,石藥集團鹽酸二甲雙胍片被納入優先審評,就是一個典型的例子。
而這種政策環境,實際上主要還是兩點,這也是在企業制劑國際化力量增厚的同時,國內市場不可忽視的兩條路徑:一是國內轉報品種納入優先審評,二是共線產品快速通過一致性評價。可以看到的是,目前國內政策對已在海外獲批的高質量ANDA品種已提供了全方位的支持,從注冊到招標到醫保都提供了配套政策。
在注冊申報層面,目前已經明確指出已在海外獲批的ANDA產品可以簡化一致性評價相關流程,如國內藥品生產企業已在歐盟、美國和日本獲準上市的仿制藥,可以國外注冊申報的相關資料為基礎,按照化學藥品新注冊分類申報藥品上市,批準上市后視同通過一致性評價;而在中國境內用同一生產線生產并在歐盟、美國和日本獲準上市的,亦視同通過一致性評價。
這就意味著這些產品無需在國內做藥學研究和BE試驗,既能節約時間又能減少研發支出。一般而言,藥學+BE需要一年時間,研發支出則在500萬至800萬元左右,如此一來制藥企業便可以以更快的速度通過一致性評價,搶占國內市場。
仍然以華海藥業為例,其申報的8個一致性評價產品于2017年6月7日或2017年7月31日獲得注冊受理,9月25日進入審評中心,7個產品于12月27日獲批成為首批通過一致性評價的國內仿制藥并進入中國上市藥品目錄集,從注冊受理到獲批僅6個月的時間,真正的審批時間僅3個月時間。此外還有6個ANDA產品轉報國內生產的注冊申請,已有5個品種進入優先審評。
而快速通過一致性評價則意味著產品在未來的市場招標中將得到巨大的優勢。按照當下的政策,同品種藥品通過一致性評價的生產企業達到3家以上的,衛生計生部門在藥品集中采購等方面不再選用未通過一致性評價的品種。而一致性評價也已在多地被納入原研競價層次。
ANDA那么多,NDA何時到來?
如果去翻看過去幾年中國制藥企業在美國獲得的ANDA認證情況就不難發現,從2012年到2015年,對中國藥企的ANDA的發證情況基本穩定,每年獲批總數和涉及企業數量幾乎完全相同。但從2016年開始,獲批水平有了一個較為明顯的提高,2017年更是如此。
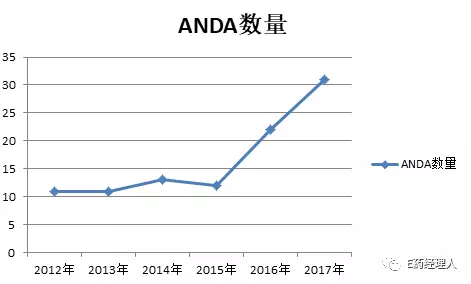
2012-2017年在美獲批ANDA數量變化
這固然是一件好事,其意味著中國制藥企業的制藥水平已經日益得到全球主流市場的認可,中國藥企在全球市場的競爭力也逐漸開始顯現。但與此同時,在另外一個更能衡量制藥水平與競爭力的指標上我們卻一直沒有突破:NDA,即新藥申請。
最為人所熟知的,應當還是天士力的復方丹參滴丸,如果從1997年12月9日其正式通過美國FDA新藥臨床研究審評(IND)開始算起,其在美國的NDA之路已經走了超過二十年,而隨著其三期臨床試驗結果的公布,復方丹參滴丸能否在美國最終完成NDA也成為了業界討論的熱點。
而另外一個被廣為討論的則是綠葉制藥的505(b)(2)產品利培酮緩釋微球肌肉注射制劑,此前其在美國已完成了一項由美國108名病人參與的關鍵性臨床試驗,并被美國FDA認為已足以支持其通過505(b)(2)途徑在美遞交新藥申請,被視為接下來最有可能率先完成新藥申請的中國企業之一。而最新的消息是,FDA已經豁免了綠葉作為新藥申請方在提交NDA的申報資料時必須提交的兒科研究計劃,這將大幅降低其藥品的研發成本,加快上市的速度。
但盡管如此,到如今我們還尚未看到有任何一個產品NDA正式完成。不過,如今中國的醫藥產業中,創新藥已經成為了一個大環境,國內自主創新藥的質量再逐年提升,即便是以“全球新”這樣一個維度來衡量,國內創新藥產業也正處于一個爆發的前夜,如亞盛醫藥、恒瑞醫藥等多家公司目前均有產品在美國獲批IND。
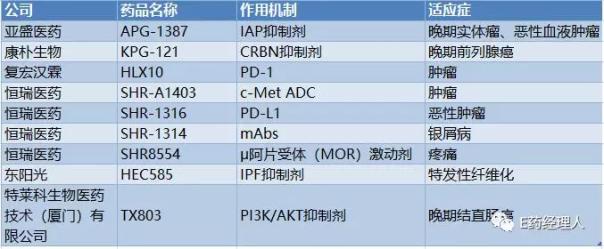
美FDA IND獲批情況統計(不完全整理)
所以我們也不妨大膽暢想,2018年,我們很有可能迎來第一個在美國拿到NDA許可上市的中國自主創新藥。到那時,中國制藥在全球市場的底氣注定將更足一些。