政策大變動,徹底影響醫療器械行業
加入日期:2018/4/26 13:55:54 查看人數: 753 作者:admin
當前,以新版《條例》為核心,以部門規章為主體,以規范性文件為補充,我國已經構建了覆蓋醫療器械監管全過程的醫療器械法規體系。這場大規模的法規巨變和制度更新帶給醫療器械行業什么影響?相關企業應該何去何從?本文試就這一問題進行探討。
一、醫療器械政策法規正在經歷巨變
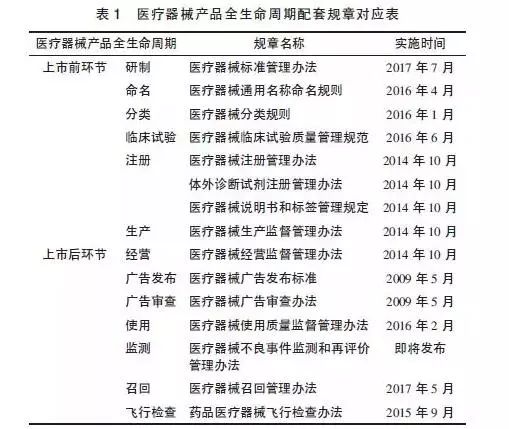
我國醫療器械法規體系的構建始于2000年《條例》的實施,經過2014年、2017年的2次修訂后,法規體系的框架已經基本確立。根據產品全生命周期管理的需要,管理部門對相關配套規章做了較大的修改,基本上把原有醫療器械法規體系的內容回爐重造了一遍(醫療器械全生命周期配套規章見表1)。同時,還發布了《創新醫療器械特別審批程序》《醫療器械優先審批程序》《醫療器械生產質量管理規范》《醫療器械經營質量管理規范》等多部規范性文件。另外,為了推動這些管理規范的實施,CFDA以各種通知、公告、通告等形式發布的規范性文件就近百項。這些立法工作構建了行政法規、部門規章、規范性文件為主體框架的三級監管體系。這一切都在說明醫療器械政策法規正在經歷著一場巨變。
二、政策法規變動對醫療器械產業發展的影響分析
根據Evaluate Med Tech的統計,2015年全球醫療器械銷售規模為3903億美元,2011-2015年全球醫療器械銷售規模穩步增長,復合年均增長率(compound annual growth rate,CAGR)為1.90%。基于120家醫療器械行業內領先公司的數據測算,2015-2020年世界醫療器械產業復合年均增長率將達到5%,到2020年市場規模達到5140億美元。根據此增速測算,2016年全球醫療器械銷售規模為4063億美元。而中國醫療器械產業的發展更令世界矚目。進入21世紀以來,國內產業整體步入高速增長階段,銷售總規模從2001年的179億元到2014年約2556億元,增長了14.28倍,國內醫療器械市場規模增速大大高于全球,成為僅次于美國的全球第二大醫療器械市場。國內醫療器械2015年市場總規模約為3080億元,2015-2020年醫療器械市場將保持20%的增速。根據此增速測算,2016年國內醫療器械銷售規模為3696億元,國內醫療器械市場規模大大高于全球增速,預計2017年將達到4942.3億元,復合年均增長率預計為15.4%。
1.對產業企業規模的影響
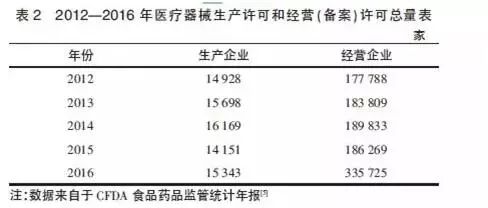
醫療器械是一個嚴格監管的產業,對生產經營主體均有資質要求,法規的修訂會對產業規模產生明顯影響,主要表現在獲得資質的主體數量變化上。2014年《條例》首次修訂后,要求生產第二類、第三類醫療器械的企業應該取得《醫療器械生產許可證》,要求經營第二類醫療器械的企業應該取得經營備案憑證,經營第三類醫療器械的企業應該取得《醫療器械經營許可證》。從表2可知,2012年到2014年持證經營的企業數量,由于法規沒有大的修改,不管是醫療器械生產企業還是經營企業,均呈緩慢增長狀態。
2015年,因為新版醫療器械藥品生產質量管理規范(goodmanufacturing practices,GMP)和首版醫療器械藥品經營質量管理規范(good supply practice,GSP)在該年的推行,醫療器械生產企業和經營企業數量均有減少,一些不符合醫療器械GMP要求的生產企業以及不符合醫療器械GSP要求的經營企業被淘汰出局,表明新政對行業產生了立竿見影的影響。
2016年,生產企業以及經營企業總量均有增加,說明新的規則被熟悉之后,更多的社會資源繼續流入醫療器械這一朝陽產業。
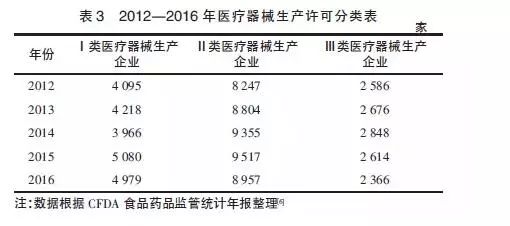
從表3中可以更深入地了解到新的政策法規實施對不同類別醫療器械生產企業的影響情況。從2012到2015年,從事第一類、第二類醫療器械生產活動的企業總體上處于增長狀態。而對生產第三類醫療器械的廠家而言,2012-2014年每年都有小幅增長,但在2015、2016年均有減少。這與2015年3月國家開始要求第三類醫療器械生產企業全面執行醫療器械GMP 有直接關系,生產質量體系不合規且整改不合格的企業直接被淘汰。
另外,我國從2015年9月開始實施《藥品醫療器械飛行檢查辦法》。管理部門利用飛行檢查手段,對醫療器械生產企業展開了密集的不預先告知的行政檢查。2016年,所有類別的生產企業數量均有所下降,這跟當年嚴厲的飛行檢查淘汰劣質企業不無關系。
2.對產品備案和注冊的影響
醫療器械產品上市狀況是行業發展的“晴雨表”,新實施的政策法規也直接影響著產品的備案和注冊數量。如表4所示,2014年《條例》將第一類醫療器械產品注冊管理調整為備案管理后,備案產品有了大幅上升,增長率達到63.5%。第一類醫療器械備案率的大幅增長,主要是由于第一類醫療器械的管理方式發生了根本變化,從注冊管理改為備案管理,刺激了第一類醫療器械的增長。
同時,第二類醫療器械的首次注冊數,從2015年的7029件下降到了2016年的6093件,降幅達到13.31%;進口醫療器械的首次注冊數,從2015年的1559件降低到了2016年的1037件,降幅達到33.48%。2項數據的下降表明2016年開展的醫療器械臨床試驗數據真實性核查行動對企業的首次注冊申報產生了實質的影響。另外,2015年開始實施的醫療器械注冊收費制度也使企業的注冊申請更為謹慎,影響了醫療器械生產企業的注冊申請數量。在這些政策影響下,企業的備案與注冊行為更為規范化,提升了產品備案與注冊申報的質量。
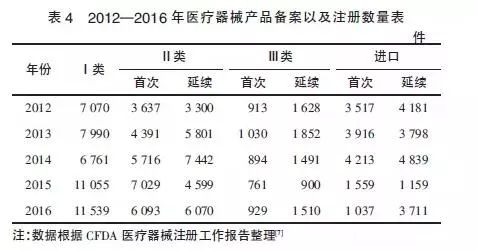
值得注意的是,2016年體外診斷試劑異軍突起,在注冊產品中占的比重很大。從CFDA公布的注冊數據看,境內第三類醫療器械中,體外診斷試劑注冊數量占全部注冊數量的43%;進口醫療器械中,體外診斷試劑注冊數量占全部注冊數量的33%。這些都表明,在醫療器械行業版圖中,體外診斷試劑所占的份額將越來越大。
我國于2014年3月開始實施《創新醫療器械特別審批程序》,允許符合條件的創新醫療器械進行特別審批。這一政策的出發點是縮短創新醫療器械的注冊審評時間,以加快產品的上市步伐。但是,創新醫療器械產品屬于高科技和學科交叉產品,風險性高,技術審評難度大,導致審評周期時間長,效率偏低。由于創新醫療器械的門檻要求高,再加上審評慢,致使該政策不能從根本上促進醫療器械行業的創新發展。
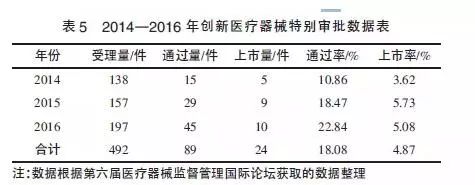
從表5可以看出,實施創新醫療器械特別審批程序后,創新醫療器械的通過量和上市量在2014-2016年均穩步增長,但由于申報量越來越大,上市率稍有起伏。2015年,CFDA批準注冊脫細胞角膜基質等9個產品上市(其中有源醫療器械5項,體外診斷試劑3項,無源醫療器械1 項)。2016年,批準注冊三維心臟電生理標測系統等10個產品上市(其中有源醫療器械6項,無源醫療器械3項,體外診斷試劑1項)。2016年,不管是創新醫療器械的注冊申請量,還是經過審評后的通過量以及最終獲批的上市量都有所上升,說明創新醫療器械特別審批這一新政繼續推動著產業技術和產品的更新。
從以上分析可知,醫療器械產業對政策與法規的變動相當敏感。相關政策和法規稍有變動,將引起行業產業的直接反應。由于醫療器械與人們的生命安全和身體健康密切相關,國家必須對它實施最為嚴厲的監管,這對產業發展的影響無疑是深遠的。
3.對產業發展環境的影響
經過大規模的政策法規變動之后,醫療器械產業發展環境也會發生很大變化。這種影響變化主要體現在制度環境變嚴和產業環境趨活2個方面:
(1)經過政策法規的調整,醫療器械管理制度的“籠子”已經編織嚴密,從嚴監管成為產業管理主軸,制度環境變嚴。2017年9月1日,《最高人民法院、最高人民檢察院關于辦理藥品、醫療器械注冊申請材料造假刑事案件適用法律若干問題的解釋》開始正式實施。該項司法解釋將藥品和醫療器械臨床試驗數據造假納入刑法處理,在刑罰層面進一步強化了行業的從嚴監管。該項司法解釋規定,藥物非臨床研究機構、藥物臨床試驗機構、合同研究組織、醫療器械臨床試驗機構、藥品醫療器械注冊申請單位、藥品醫療器械監管部門及其工作人員故意提供虛假的醫療器械臨床試驗報告及相關材料,情節嚴重的,以提供虛假證明文件罪追究刑事責任。除此之外,管理部門頻繁的飛行檢查、“雙隨機”檢查、抽驗檢查以及臨床數據真實性核查等行政檢查活動,也使行業的制度環境變嚴了。
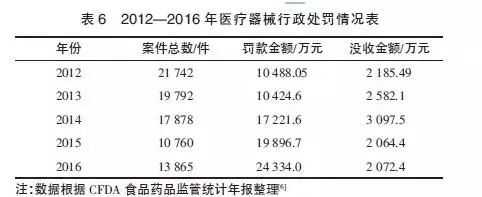
2017年5月4日,國務院發布了關于修訂《醫療器械監督管理條例》(以下簡稱《條例》)的決定,這已經是這部醫療器械行業“母法”在短時間內的第二次修改,引起了醫療器械行業企業的極大關注。2014年,《條例》第一次修訂后,管理部門大幅更新了配套的部門規章,從而使醫療器械全過程各個環節均有法可依。
從表6可知,2012-2016年,行政處罰案件總數起伏不定。2015年查處的案件總數發生劇降,2016年有所回升。這表明《條例》修訂后,由于不熟悉新的罰則,管理部門查處違法行為的行動力有所減弱,但后期增強了。從2013年起,罰款金額作為一個主要的處罰指標一直穩步上升,表明對醫療器械的監管力度和處罰力度仍在持續加強。由于法規加大了處罰力度,因企業生產經營方面的合規問題被罰高達近千萬元的案例并不罕見。這是廣大醫療器械生產企業所不能懈怠的。
(2)系列關于鼓勵行業創新發展的利好政策的出臺,給行業帶來新的發展機遇,產業發展環境趨向活躍。除了《創新醫療器械特別審批程序》這一政策將持續推動產業技術與產品的創新之外,2017年1月開始實施的《醫療器械優先審批程序》,將加快那些治療罕見病、惡性腫瘤有明顯臨床優勢或列入國家科技重大專項、國家重點研發計劃的器械上市步伐。
2017年5月11-12日,CFDA連續發布了2017年第52、53、54、55號等4個關于鼓勵藥品醫療器械創新政策征求意見稿的公告,體現了藥品醫療器械管理的改革趨勢。4份征求意見稿中,與醫療器械密切相關的政策動態主要有以下幾點:一是要建立醫療器械審評團隊負責創新類醫療器械審評并實施項目管理人制度,這將直接提高當前創新醫療器械的審評效率,并加強其審評的公正性;二是將醫療器械臨床試驗機構資格認定改為備案管理,鼓勵社會資本投資成立臨床試驗機構,完善倫理委員會機制并接受境外臨床試驗數據用于醫療器械注冊審評,這既給改善當前醫療器械臨床試驗機構不足的窘境提供了方法途徑,又使一些擁有境外臨床試驗資源的企業能夠搶占注冊審批先機;三是將藥品上市許可持有人制度實施的經驗推廣到醫療器械注冊環節,完善醫療器械不良事件報告和再評價制度,建立職業化的醫療器械檢查員隊伍等,未來醫療器械的生產與注冊將進一步解綁,以放寬醫療器械注冊申請人的諸多限制,從而刺激行業創新發展。
2017年10月8日,中共中央辦公廳、國務院辦公廳印發了《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》,為解決以上問題做出了頂層設計,一些長期困擾醫療器械行業創新發展的瓶頸將會打破,這將對醫療器械產業的創新發展產生深遠而又重大的影響。
三、政策法規變動下醫療器械產業發展的建議
從上述分析可知,醫療器械政策法規目前正處于變動期,并呈現出明顯的嚴厲趨勢。在日益趨嚴的產業環境中,政策法規的靈活性給行業帶來了發展機遇。未來,企業既要下大力氣做好質量合規,以便滿足嚴格的監管要求;又要善于利用政策紅利,捕捉難得的發展機會。
1.把握醫療器械政策法規發展方向順勢而為。
《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》反映了產業管理的最新發展動向,企業應該從中準確把握醫療器械政策法規發展的趨勢,及早布局籌劃新的發展規劃。尤其是關于醫療器械注冊審評的改革動向,企業應該保持密切關注。
2.做好醫療器械上市前質量合規管理。
在從嚴監管的行業環境下,企業必須扎實履行好法規規定的法律義務,尤其是要做好醫療器械產品上市前的質量合規管理。企業應該在研發、檢驗、臨床試驗、注冊以及生產等上市前環節里,不折不扣履行法律法規規定的義務,確保質量管理體系有效運行。2017年新修訂的《條例》已經將醫療器械臨床試驗機構的資質認定改為備案管理,這已經在立法上先于藥品確定了臨床試驗機構的備案管理制度。未來將有更多符合條件的機構能夠提供專業的臨床試驗服務,這對于醫療器械的質量合規大有裨益。但如前所述,對于在醫療器械注冊申請過程中材料弄虛作假的情形,情節嚴重的,可能追究刑事責任。嚴厲的責任規定,應該成為企業不可觸碰的紅線。
3.履行醫療器械上市后企業主體責任。
未來,基于產品全生命周期管理的需要,管理的重心將繼續從產品上市前審批向上市后監測轉移,從而也要求企業在產業發展全程中承擔一以貫之的法律義務。醫療器械生產企業以及使用單位應當按照上市后產品的不良事件監測、再評價以及召回的相關規定,積極申報不良事件和召回缺陷產品。企業應加強自律,嚴格把關產品質量,防止不良事件的發生對產業造成打擊。醫療機構應對在用醫療器械做好集中管理,使其把有限的人力、財力、精力都集中到醫療技術上,提升內涵、持續創新、提高診療水平和質量,使醫療技術更富含金量。
4.實施行業產業差異化發展策略。
當前,醫療模式正在從過去的診斷—治療模式向著預防—診斷—治療—康復—保健模式轉變。在此背景下,醫療需求將呈現新的趨勢,家用醫療儀器、家用輔助類機器人設備、社區康復用醫療設備、面向電子健康檔案的技術與產品將會成為新的熱點產品領域。在新的法規和政策環境中,3D 打印醫療器械、移動醫療設備、基因測序、家用醫療器械等細分行業應該抓住機遇,以差異化發展策略取得競爭優勢。
4、結語
2014年以來,我國醫療器械政策法規發生的巨變改變了產業發展的環境,醫療器械產業經歷了制度和行業的雙重分水嶺。在醫療器械政策法規體系得到長足發展的背景下,產業從嚴監管的主題將在未來長期堅持不變。在這一政策法規巨變背景下,醫療器械產業也面臨著難得的發展機遇。如果企業能夠順應法規的變化,嚴格在法律的框架下開展生產經營活動并履行好自身的主體責任,注重技術與產品的創新并實施差異化競爭的策略,必將能推動