這些政策進度藥企必須關注!
加入日期:2019/2/16 8:45:23 查看人數: 1178 作者:admin
系列醫藥政策改革對中國醫藥行業影響頗深,不管是促進藥品創新、提高藥品質量療效,還是降低藥品價格等,對各方面都有積極而深遠的意義。
各項政策改革和試點工作有條不紊地進行,包括MAH試點、仿制藥一致性評價、藥品關聯審評、創新藥品優先審評、“4+7”帶量采購試點等;并計劃對疫苗管理單獨立法,修訂現有的藥品管理法,發布2020版《中國藥典》,相關修訂稿也在征求意見。
緊鑼密鼓:
五張成績單
藥品受理情況匯總
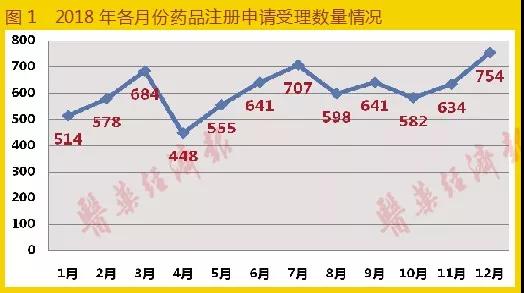
2018年,CDE承辦受理的各類藥品注冊申請共7336條(含輔料申請),相比去年同期4837條增長51.7%。主要增長點在藥品補充申請方面,這可能與2018年年末是289目錄仿制藥一致性評價工作和MAH試點工作截止日有關,大量企業趕在大限到來之前扎堆申報。其中化學藥注冊申請5969條,中藥注冊申請413條,生物制品注冊申請923條,體外試劑申請21條。
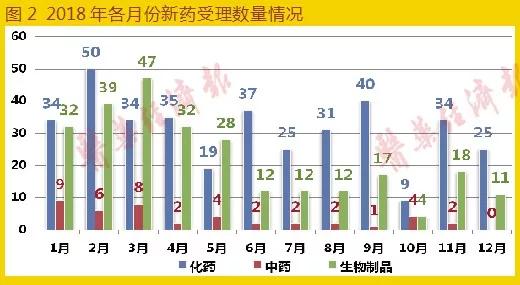
新藥申請共682條,與去年同期618條相比增長10.4%,變化不大。化藥新藥申請共373條,中藥新藥申請共42條,生物制品新藥申請共264條。
2018年截至10月17日,CDE共發布了8批次共197個擬納入優先審評程序的藥品注冊申請名單,具體各批次數量如圖3所示(2018年為第26~33批)。在2018年11月7日之后,CDE發布公告不再對擬納入優先審評程序的藥品按批進行公示,調整為即到即審方式組織專家進行審核,確定優先審評的品種。
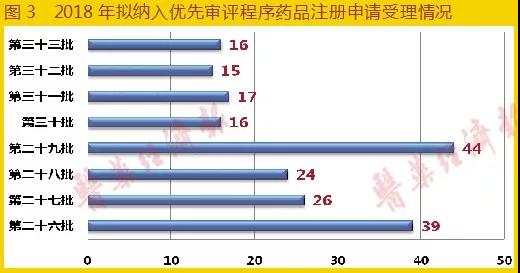
2018年全年,共有336個品種納入優先審評名單,相比2017年同期237個品種增長41.8%,標志著我國藥品創新能力和審評效率得到了很大提升。
仿制藥一致性評價
2016年3月5日,國務院正式發文要求開展仿制藥一致性評價工作,確定了首批289個必須在2018年底前完成一致性評價的化學口服固體制劑品種目錄。
公告發布至今,共發布了19批次1151條參比制劑目錄,并于2017年11月11日和2018年7月31日分別發布了兩批次《可豁免或簡化人體生物等效性試驗(BE)品種》目錄,共涵蓋72個品種。
截至2018年年底,有關一致性評價累計受理號已達708個,涉及253家企業的205個品種,已有149個品規通過或視同通過仿制藥一致性評價,但289目錄中僅有62個品規32個品種通過了一致性評價。其中,1個品規通過企業有5家,3個品規通過企業有4家,6個品規通過企業有3家,14個品規通過企業有2家,86個品規通過企業有1家。涉及289目錄品種的通過率為11.1%。
2018年12月28日,《國家藥品監督管理局關于仿制藥質量和療效一致性評價有關事項的公告》和《關于仿制藥質量和療效一致性評價有關事項的公告》政策解讀發布,將通過一致性評價的品種優先納入目錄,未通過一致性評價的品種將逐步被調出目錄,對納入國家基本藥物目錄的品種不再統一設置評價時限要求。
這意味著“289目錄藥品”一致性評價大限延期了。但延期并不代表可以無限拖后,仍有 “自首家品種通過一致性評價后,其他藥品生產企業的相同品種原則上應在3年內完成一致性評價。逾期未完成的,企業經評估認為屬于臨床必需、市場短缺品種的,可向所在地省級藥監部門提出延期評價申請,經省級藥監部門會同衛生行政部門組織研究認定后,可予適當延期”的規定。
“289目錄藥品”的整體延期,給各藥企緊繃的神經稍微松了一下弦,可以有更多時間進行一致性評價的考量和研究工作。但是,為了保證自身競爭力,盡快通過一致性評價才是正途。
MAH試點進展
MAH(藥品上市許可持有人)試點工作也迎來了延期,2018年10月27日發布了MAH試點工作延長一年的決定。
延期的主要原因是要與《藥品管理法》的修訂工作相銜接。據流出的修訂稿,MAH將是新版藥品管理法的修訂重點之一。
MAH制度落實了持有人法律責任,持有人負責藥品生產銷售全鏈條和藥品全生命周期管理。該制度試行后,試點各省市積極響應,發布了一系列優惠政策和指導原則,2016年各省市提交的試點品種申報總數就已經達到了165個,其中臨床試驗申請有97個,上市申請44個,補充申請24個,提交申報數量最多的省份是廣東省,有47個,緊隨其后的是江蘇和上海,分別為38個和25個。2016年12月23日,齊魯制藥的吉非替尼及片劑成為我國首個MAH制度試點品種。
進入2017年后,MAH申請試點工作成果顯著,從第一個獲批的MAH創新藥品種,到第一個通過MAH制度完成藥品生產技術轉移,再到第一個MAH試點中藥品種,以及第一個支持獲批創新藥的受托企業。
試點三年多來,激發藥物創新活力、優化資源配置、減少重復建設等預期作用逐步顯現。跨省委托生產的相關政策也正在研究商討中,試點工作結束后在多個地區推行的前景可期。
藥品關聯審評
根據CDE官網數據庫,截至2019年1月8日,原料藥登記數量共2717條,其中激活并批準完成與上市制劑聯合審評審批的數量為172條,占比6.33%;輔料登記數量共1316條,其中激活并批準完成與上市制劑聯合審評審批的數量為19條,占比1.44%;藥包材登記數量共2741條,其中激活并批準完成與上市制劑聯合審評審批的數量為3條,占比0.11%。
這個結果受到藥品審評所需時限和政策過渡的影響,具體而言有以下三點:
1.政策公布前已經獲得注冊批件或再注冊批件的原輔料包材產品的證書,只要還在有效期內,依然可以在藥物制劑中使用,因此這些廠商對于申請藥品關聯審評的熱情不大。待證書到期后,完成關聯審評的數量將逐步上升。
2.政策公布后,申請的原輔料包材產品前期研究工作時,大部分未尋找相應制劑廠家合作進行聯合申報,需臨時尋找制劑廠商重新申報。
3.政策變更后,相關申報資料要求日趨嚴格,審評標準也相應提高。另外,對于原輔料包材產品還新增了年度報告的要求,生產企業和審評人員都需要一段時間去整改和適應新的政策要求。
隨著相關政策和指導原則的不斷完善,以及先前原輔料和藥包材“政策福利”逐漸到期,加上一致性評價工作和MAH制度對高質量藥用原輔料和藥包材需求的不斷提高,將促使更多原輔料和藥包材企業積極尋找與藥用制劑廠商的合作,并不斷提高自身產品的質量。
“4+7”帶量采購
2018年11月14日,“4+7帶量采購試點工作”啟動。采購藥品多數為通過了藥品一致性評價的品種,目的是為了在提高藥品質量的同時進一步降低藥品價格。從“預中選”到“擬中選”,根據申報企業數、報價、銷售量等具體情況進行了細致的規定。為確保中選藥品及時配送,還設置了“應急預案”,將對“違規名單”企業停止采購資格,并啟動應急預案。
最終,本次帶量采購共有25個產品成功降價,平均降價幅度52%,最高降幅達到96%。
2019年1月17日,國務院辦公廳《國家組織藥品集中采購和使用試點方案》進一步明確了四大保障措施:帶量采購,以量換價;招采合一,保證使用;確保質量,保障供應;保證匯款,降低交易成本。
“4+7”帶量采購雖為試點,但可謂我國藥品招采未來走向的風向標。其在正式實施的過程中,相關的配套細則如何規定,讓我們拭目以待。
即將發布:
三個關鍵政策
為了更好地保障用藥的安全性和可及性,一些重磅的醫藥政策已經在醞釀中,在不久的將來,也將對國內醫藥行業產生深刻影響。
疫苗管理法
為了更好地對疫苗研制、生產、流通、預防接種的全過程進行監控,我國擬對疫苗管理單獨立法,建立起系統全鏈條的疫苗管理制度,突出疫苗管理特點,強化疫苗的風險管理、全程控制、嚴格監管和社會共治,切實保證疫苗安全、有效和規范接種。
新版藥品管理法及管理條例
從最新流出稿可以看出,對藥品的管理要求和力度將全面上升;新增了與藥品上市許可持有人、藥品專利、藥品保險制度等有關的多項條例;優化藥品審評的人員結構配置,對藥品審評人員的專業水平也有了更高的要求。
《中國藥典》2020年版
時間已經來到2019年,距2020版藥典的發布日期越來越近,各項編修和校準核對工作也已接近尾聲。
根據征求意見稿,預計收載品種總數6400個左右,其中:中藥增加品種約220個,化學藥增加品種約420個,生物制品增加品種收載30個,藥用輔料增加品種約100個,藥包材品種收載30個,共約800個。藥典已收載品種計劃修訂1400個,其中:中藥500個,化藥600個,生物制品150個,藥用輔料150個。
加大對已取消文號、長期不生產、質量不可控、劑型不合理、穩定性不高的藥品標準的淘汰力度,進一步從橫向和縱向對涉及各類藥品的藥典凡例、制劑通則、總論、檢驗方法以及指導原則等進行編制與修訂,逐步加強和完善涉及藥品研發、生產、流通和使用等環節的通用性技術要求以及指導原則體系的建設。