藥監局抽檢結果:這些醫療器械暫不能賣了(附清單)
加入日期:2020/11/20 10:08:54 查看人數: 1899 作者:admin
27批產品不合格
11月17日,國家藥監局關于發布了國家醫療器械監督抽檢結果的通告,在對半導體激光治療機、超聲潔牙設備、手術衣等5個品種的產品進行了質量監督抽檢時,共27批(臺)產品不符合標準規定。
被抽檢項目不符合標準規定的醫療器械產品包括:
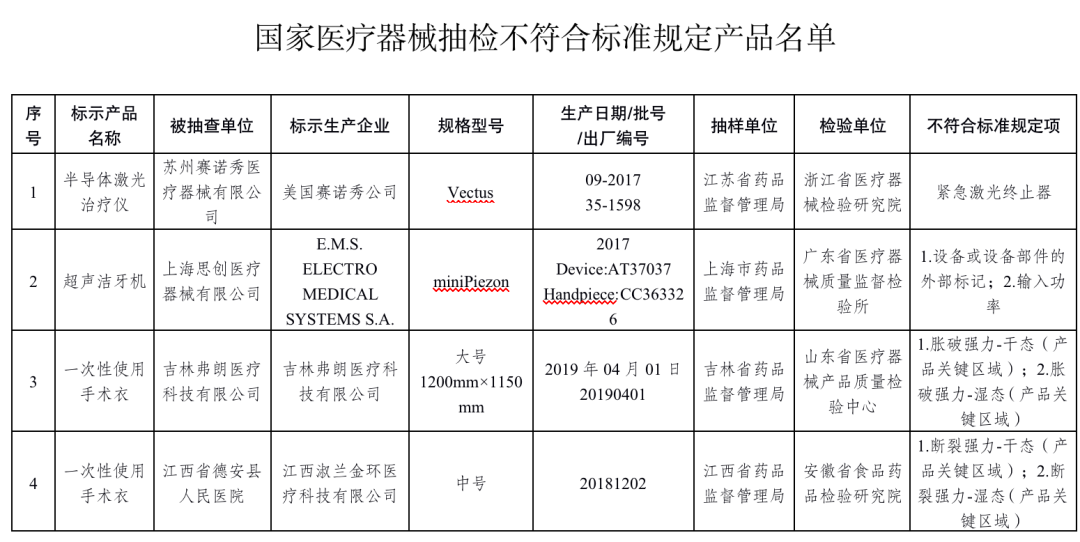
半導體激光治療機1臺產品:美國賽諾秀公司生產,涉及緊急激光終止器不符合標準規定。
超聲潔牙設備1臺產品:E.M.S. ELECTRO MEDICAL SYSTEMS S.A.生產,涉及設備或設備部件的外部標記、輸入功率不符合標準規定。
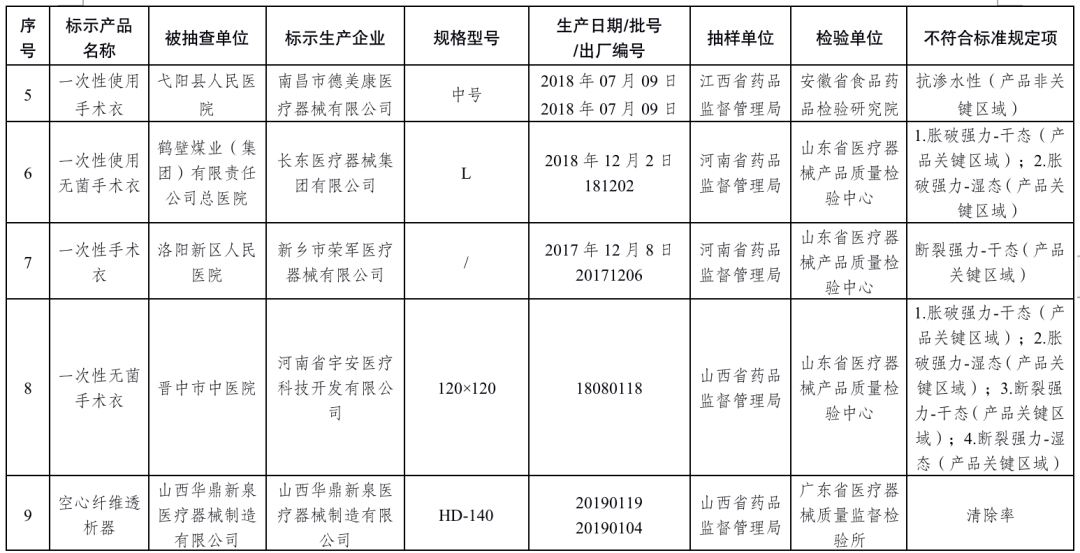
手術衣6批次產品:吉林弗朗醫療科技有限公司、江西淑蘭金環醫療科技有限公司、南昌市德美康醫療器械有限公司、長東醫療器械集團有限公司、新鄉市榮軍醫療器械有限公司、河南省宇安醫療科技開發有限公司生產,涉及脹破強力-干態(產品關鍵區域)、脹破強力-濕態(產品關鍵區域)、斷裂強力-干態(產品關鍵區域)、斷裂強力-濕態(產品關鍵區域)、抗滲水性(產品非關鍵區域)不符合標準規定。
血液透析器1批次產品:山西華鼎新泉醫療器械制造有限公司生產,涉及清除率不符合標準規定。
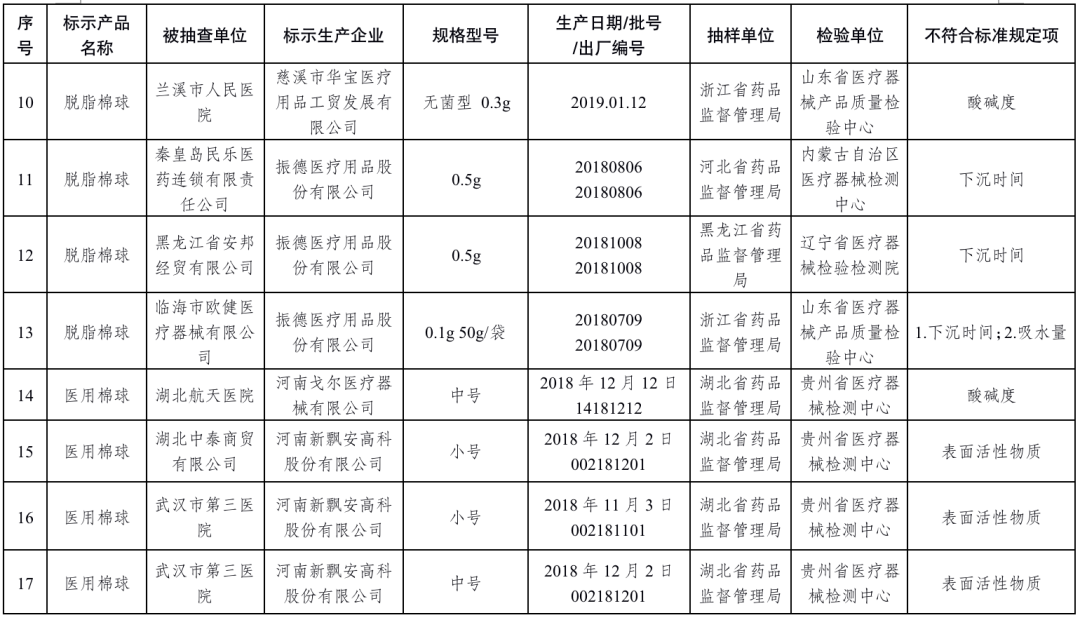
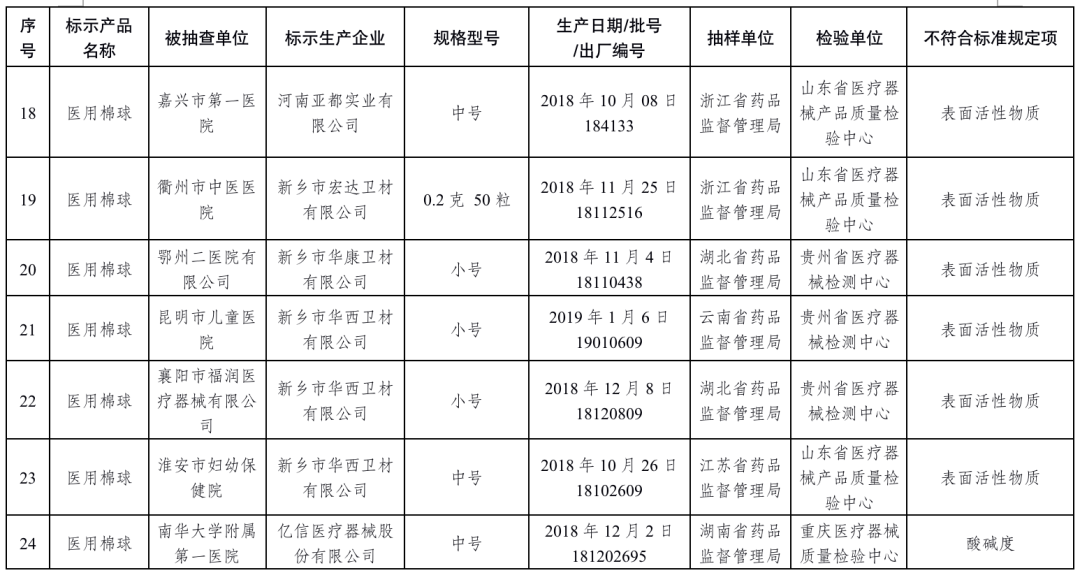
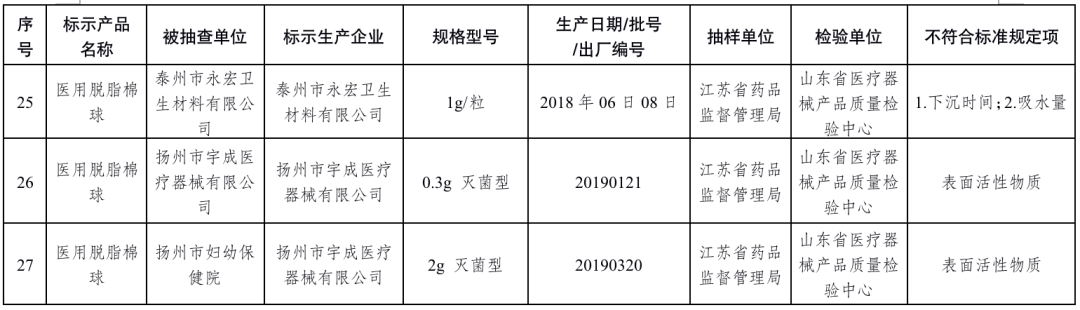
醫用脫脂棉18批次產品:慈溪市華寶醫療用品工貿發展有限公司、振德醫療用品股份有限公司、河南戈爾醫療器械有限公司、河南新飄安高科股份有限公司、河南亞都實業有限公司、新鄉市宏達衛材有限公司、新鄉市華康衛材有限公司、新鄉市華西衛材有限公司、億信醫療器械股份有限公司、泰州市永宏衛生材料有限公司、揚州市宇成醫療器械有限公司生產,涉及酸堿度、下沉時間、吸水量、表面活性物質不符合標準規定。
不合格產品按法規處理
國家藥監局指出,對上述抽檢中發現的不符合標準規定產品,國家藥品監督管理局已要求企業所在地省級藥品監督管理部門按照《醫療器械監督管理條例》《醫療器械生產監督管理辦法》和《醫療器械召回管理辦法》等法規規章要求,及時作出行政處理決定并向社會公布。
企業所在地省級藥品監督管理部門要督促相關企業對抽檢不符合標準規定的產品進行風險評估,根據醫療器械缺陷的嚴重程度確定召回級別,主動召回產品并公開召回信息;督促企業盡快查明產品不合格原因,制定整改措施并按期整改到位。
據賽柏藍器械觀察,國家藥監局近日發布多項對企業飛行檢查情況的通告,發現企業質量管理體系主要存在缺陷,主要涉及機構與人員、生產管理、質量控制、不良事件監測、分析和改進、設備、設計與開發等方面。
而以不發通知、不打招呼、直插企業的方式是最能看到真實情況的方法之一。暗訪是這種方式,飛行檢查也同樣是。
對于飛檢,是主要關注企業的生產質量管理體系,專業檢查組不遠千里來到企業的目的就在于指出問題,督促企業生產質量管理體系進行持續改進。
在檢查方式上,檢查將采取事先不發通知、不打招呼、不聽匯報、不用陪同接待、直奔基層、直插現場的方式,查找企業存在的突出問題及薄弱環節。
在飛行檢查已經常態化的情況下,飛行檢查中還有哪些重點?下面是根據公開資料搜集整理到的飛行檢查條款匯總,供參考。
醫療器械六大檢查要點(38個子項目)
(一)財務部
1、往來打款賬務--對公打款賬號。
2、打款憑證--相關人員簽字審批。
3、賬目分類--每月打印科目類別(應收、應付、結余)。
4、稅票與隨貨同行單據金額一致。
5、隨貨同行單據品種明細與稅務清單品種、金額一致。
6、查工資表--發放工資記錄明細。
(二)行政部
7、查員工花名冊--人員學歷。
8、培訓檔案--年度培訓計劃、培訓試卷、培訓課件。
(三)采購部
9、供貨方資質--許可證、GSP、開戶行、營業執照、一般納稅人資質、委托范圍、委托時間、委托區域。
10、供貨方隨貨同行單--顏色、單據內容、單據鮮章樣式。
11、印章備案與最近購貨票據核對。
12、開戶許可證與轉賬賬號與稅票中賬號。
13、供貨單位--經營范圍(采購現場操作制做采購計劃:查超范圍,系統能否管控)。
(四)銷售部
14、下游客戶資料--醫療機構許可證、營業執照、委托書、委托人身份證復印件、委托時間(均蓋鮮印章)。
15、含特殊藥口復方制劑(蛋肽)回執單---送貨員、發貨員、復核員、送達收貨人、時間。
16、冷鏈藥品--運輸記錄、交接記錄、自提記錄、交接回執(回執單內容--供貨單位、購貨單位、購貨時間、發運時間、發運溫度、到貨溫度、購買藥品數量、金額、生產廠家、批準文號、運輸員、復核員、銷售員、開票員、購貨單位收貨簽字、時間、蓋章)。
17、銷售流向明細---含特殊藥品復方制劉(復方甘草口服溶液、氨酚待因等)近幾月單次采購數量較大(20 瓶/盒以上)。
18、銷售流同明細--終止(購買單位--證可證《執業許可證》委托人身份證復印件、委托書)。
(五)質量管理部
19、公司 GSP 文件--制度、職責、操作規程。
20、藥品質量檔案--首營品種檔案(原始文件電子版不認可)。
21、首營企業--審批流程(現場演練)隨機抽取檔案資料。
22、驗收--冷鏈藥品操作、檢驗報告、系統操作流程。
23、供貨商檔案審批--審批表(相關人員系統審核、實際操作)。
24、驗證--冷車驗證資料、付款明細、簽訂合動、參與驗證人員。
25、驗證--現場操作。
26、冷車、保溫箱--驗證單位資料、付款憑證、稅。
27、內審--專項內審(簽字、參與人員提問)。
28、信息管理員--提問(維護、使用、設置權限、UPS)協助質量審核計算機權限控制(查權限管理有無漏洞)。
(六)儲運部
29、藥品分類存放---赍貨區(上架)整件區。
30、庫房面積--陰涼?常溫?
31、庫區面積總面積--陰涼庫?㎡ 常溫庫?㎡ 中藥飲片庫?㎡。
32、藥品堆碼--混垛情況、間距(離墻、地、管道)。
33、庫房設備--溫濕度控制器、除濕機、風幕機、發電機。
34、冷庫--使用、藥品分類堆碼、冷鏈藥品收貨、驗收、復核、發貨。
35、保溫箱--現場演練操作裝廂(提問)。
36、藥品儲存條件 --常溫?陰涼?
37、特殊管理藥品--儲存管理 、收貨、驗收、復核、發貨操作。
38、冷鏈藥品--收貨、驗收、發貨、復核、送貨現場操作。
八大檢查重點(20個子項目)
(一)質管人員
1、質量負責人--掛靠(現場拿制度抽取提問、問工資待遇)。
(二)質量管理部
2、質量機構責任人--掛靠(提問參加過的內審時間、驗證參加人員,驗證公司名字)。
(三)財務
3、應收、應付、余額(查有無過票行為)。
4、員工工資表--查掛靠與實經營操作。
(四)特殊藥品復方制劑
5、供貨單位資料(經營范圍、稅票、憑證、明細)。
6、購買單位資料
A、有無現金購買—查單據憑證(相應委托人簽字)。
B、查 2015 購買明細--購買數量較大者:重查--資質、銷售票據、回執單。
7、抽取在庫商品
A、某批次購進數量、銷售數量、庫存數量。
B、提供明細、相應批次隨貨單據、稅票、轉款憑證。
C、供貨單位資料--經營范圍、開戶許可號與轉賬號與稅票中賬號是否一致。
D、檢驗報告書、注冊批件、藥品質量檔案。
(五)冷藏品
8、供貨單位--資料、運輸方式、運輸工具、記錄檔案(數據、交接單據)。
9、冷藏應急--突發情況如何處理(車壞掉、保溫箱溫度過低過高、被搶等)。
10、現場操作冷藏藥品發貨演練。
11、現場演練冷藏藥品送貨環節(送達操作、數據如何給購買單位)。
12、冷藏藥品--送達方式(考質量、運輸員、銷售員)如何選取既有效又能保證質量的運輸工具。
(六)計算機權限管控--打印紙質檔案(對應各人員查看系統)
13、信息管理員--隨意修改數據(有記錄?有審批?)
14、質量管理部—如何審核各崗位權限能有效防止不越權?
A、供貨商--采購(經理、內勤;供貨商經營范圍。
B、購買客戶(銷售經理、銷售員、銷售內勒)、經營范圍。
(七)蛋肽藥品
15、胰島素 --購進、銷售、庫存流向;上家資料、下家資料;首營藥品質量信息、
16、專查進口產品--注冊批件(初建檔資料《首營品種》紙質板與系統內審批都看)
(八)設施設備
17、驗證--探險頭(多少個)、后臺運行管理系統(如何進入,如何操作,誰操作,數據是否能修改?)。
18、驗證參與人員--隨機抽取查問(看有沒有造假)驗證時間、參加人員。
19、驗證所有資料詳細查問。
20、查設備購買資料,付款,及稅票原件。