中國醫療器械標準管理年報(2021年度)
加入日期:2022/3/2 9:23:07 查看人數: 2568 作者:admin
2021年,國家藥監局堅持以習近平新時代中國特色社會主義思想為指導,把握新發展階段,貫徹新發展理念,以推動高質量發展為主題,以規范管理為切入點,嚴格落實“最嚴謹的標準”要求,統籌推動醫療器械標準各項工作。
做好標準體系頂層設計
2021年3月26日,國家藥監局、國家標準委聯合發布《關于進一步促進醫療器械標準化工作高質量發展的意見》(以下簡稱《意見》)。《意見》明確了到2025年基本建成適應醫療器械全生命周期管理需要,符合嚴守安全底線和助推質量發展高線新要求,與國際接軌、有中國特色、科學先進的醫療器械標準體系,實現標準質量全面提升,標準供給更加優質、及時、多元,標準管理更加健全、高效、協調,標準國際交流合作更加深入、更富成效的目標;提出了推進醫療器械標準化工作高質量發展的六大任務和三大保障措施。結合各領域“十四五”標準體系發展規劃和監管實際,印發了《意見》任務分工,擘畫了“十四五”期間醫療器械標準體系建設的頂層設計和標準化工作高質量發展的藍圖。
健全標準組織框架
2021年,國家藥監局整合各方資源,積極推動在監管急需領域、創新領域成立標準化技術組織,先后批準成立全國醫療器械臨床評價、醫用高通量測序2個標準化技術歸口單位。
截至2021年12月31日,醫療器械標準化(分)技術委員會或技術歸口單位[以下統稱標委會(技術歸口單位)]數量已增長到35個,包括13個總標委會(TC)、13個分標委會(SC)和9個技術歸口單位。
指導全國外科植入物和矯形器械等4個標準化技術委員會換屆和全國麻醉和呼吸設備等9個標委會委員調整。全國醫用臨床檢驗實驗室和體外診斷系統標準化技術委員會(SAC/TC136)及全國醫療器械生物學評價標準化技術委員會(SAC/TC248)2個標委會先后在國家標準委組織開展的全國專業標準化技術委員會考核評估中結果為一級。
研制疫情防控標準
健全我國疫情防控標準體系
組織制定《新型冠狀病毒核酸檢測試劑盒質量評價要求》《新型冠狀病毒抗原檢測試劑盒質量評價要求》《新型冠狀病毒抗體檢測試劑盒質量評價要求》《新型冠狀病毒IgM抗體檢測試劑盒質量評價要求》《新型冠狀病毒IgG抗體檢測試劑盒質量評價要求》5項推薦性國家標準。上述標準已于2021年11月26日正式發布,從核酸、抗原及抗體檢測為新型冠狀病毒檢測試劑的質量評價提供了技術支撐。
結合新冠肺炎疫情防控常態化管理要求,以及醫用防護產業發展需求,組織GB 19083—2010《醫用防護口罩》和GB 19082—2009《醫用一次性防護服》修訂;組織制定正壓防護服、傳染病患者運送負壓隔離艙等4項生物防護相關行業標準。
積極助力國際疫情防控
2021年8月30日,國際標準ISO 80601-2-90:2021《醫用電氣設備 第2-90部分:高流量呼吸治療設備的基本安全和基本性能專用要求》,由國際標準化組織(International Organization for Standardization,ISO)和國際電工委員會(International Electrotechnical Commission,IEC)官網發布,這是由我國提出并負責完成的首個新冠肺炎疫情防控醫療器械國際標準項目。該標準的發布填補了此類產品國際標準的空白,為保障高流量呼吸治療設備的安全有效,促進國際流通起到了積極作用,為全球疫情防控提供技術支持和貢獻中國智慧。
積極參與國際標準技術規范ISO/TS 5798《通過核酸擴增方法檢測新冠病毒的質量規范》制定工作,目前已進入工作組草案(WD)階段。
組織制定的《醫用防護口罩技術要求》等2項新冠疫情防控相關國家標準外文版已正式發布。
優化評估強制性標準
2021年3月29日,為進一步優化醫療器械強制性標準體系,國家藥監局綜合和規劃財務司印發《醫療器械強制性標準優化工作方案》,確定了工作目標、總體要求,進一步明晰了醫療器械強制性標準和推薦性標準的范疇,以及標準修訂、廢止、轉化的情形;明確了職責分工、進度安排和工作要求。
根據工作方案,擬轉化為推薦性標準126項,轉化為強制性國家標準14項,廢止17項,修訂(含整合)122項,保持繼續有效179項(見圖1)。上述優化評估結果已在國家藥監局網站公示。

完成標準制修訂任務
2021年下達醫療器械國家標準制修訂計劃38項,醫療器械行業標準制修訂計劃79項;發布醫療器械國家標準35項,醫療器械行業標準146項,醫療器械行業標準修改單3項。截至2021年12月31日,醫療器械標準共計1849項(見表),醫療器械標準體系持續優化。

標準數量持續提升
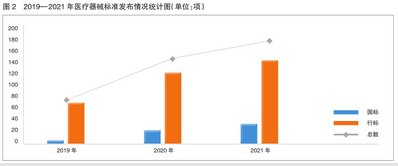
2021年共發布醫療器械標準181項,標準發布數量較上一年度增長21%。近3年來,醫療器械標準發布數量穩步提升(見圖2)。其中,國家標準發布數量增長顯著。
體系結構更加優化
截至2021年12月31日,按標準規范對象統計,現行有效的醫療器械標準中基礎標準301項,占比16%;管理標準47項,占比3%;方法標準448項,占比24%;產品標準1053項,占比57%。
2021年發布的181項標準中,基礎標準44項,占比24%;管理標準8項,占比4%;方法標準32項,占比18%;產品標準97項,占比54%。
重點支持基礎通用和監管急需標準制定。2021年發布的35項國家標準中,18項為醫用電氣設備GB 9706.1配套的系列專用安全標準,5項為新冠病毒檢測試劑質量評價要求標準,6項為臨床檢驗醫學實驗室質量和能力要求系列標準,2項為醫療器械生物學評價系列基礎通用標準,基礎通用標準和疫情防控、監管急需標準占比達89%。
覆蓋領域更加全面
截至2021年12月31日,按標準規范對象統計,現行有效的醫療器械標準按照《中國標準文獻分類法》,主要歸類在醫療器械綜合(C30)至醫用衛生用品(C48)之間,占比前5位的分別是:醫用化驗設備(C44)14%,矯形外科、骨科器械(C35)11%,一般與顯微外科器械(C31)11%,口腔科器械、設備與材料(C33)10%,醫用射線設備(C43)9%。醫療器械標準基本覆蓋醫用電氣設備、手術器械、外科植入物等醫療器械各技術領域。
2021年發布的181項標準中,發布數量排名前3的領域分別是醫用化驗設備(C44)、醫療器械綜合(C30)、醫用射線設備(C43)。
推進急需標準快速制定,落實《意見》要求,對新興產業等監管急需標準緊急立項、快速制定、及時發布。如加快組織制定發布《重組膠原蛋白》等產業監管急需標準。
標準效力得到增強
在對存量醫療器械強制性標準進行優化評估的基礎上,進一步落實《意見》要求,將增量醫療器械強制性標準嚴格限定在涉及基本安全、性能要求,涉及安全的基礎通用性技術要求和涉及《醫療器械安全和性能的基本原則》有關要求的范疇。2021年共發布醫療器械強制性標準41項,其中國家標準17項,行業標準24項。41項強制性標準中,34項為GB 9706.1配套的醫用電氣設備并列和專用安全標準,占比達83%;其余7項強制性標準中,有 2項強制性標準整合代替了原來的8項強制性標準。
建立標準管理長效機制
優化標準制修訂工作機制
鼓勵企業、科研院所、社會團體等各相關方積極參與標準制修訂工作。建立并完善標準信息化平臺,在標管中心網站及時公開標準發布公告、計劃通知、立項/委員征集信息等,標準制修訂過程信息100%對外公開,引導各方積極參與標準制修訂工作。
完善標準實施反饋機制
2021年國家藥監局建立并運行醫療器械標準實施反饋機制,形成了標準制修訂全鏈條閉環管理。
建立醫療器械標準意見反饋信息系統。自2021年7月1日起在國家藥監局醫療器械標準管理中心網站運行,進一步健全了醫療器械標準實施反饋平臺和溝通渠道。對公眾反饋的標準實施意見,組織研究處理,做到條條有回復、件件有處理。
參與國際標準制修訂
我國主導制定的2項國際標準正式發布
除由我國主導制定的首個新冠肺炎疫情防控相關醫療器械國際標準ISO 80601-2-90:2021外,首個由我國醫療器械行業標準(標準號:YY/T 1553—2017)轉化的國際標準ISO 22679—2021《心血管植入物-心臟封堵器》于2021年11月正式發布。該國際標準的發布標志著我國醫療器械標準在持續提升與國際標準一致性程度的基礎上,逐步開始探索將我國標準推廣到國際。
積極研提國際標準新項目
2021年共提出《計算機體層攝影設備的能譜成像 性能評價方法》《外科器械 吻合器 第1部分:術語和定義》《外科器械 吻合器 第2部分:通用要求》《膠原蛋白特征多肽定量測定方法標準》《脫細胞基質支架材料中殘留DNA定量測定方法標準》等6項醫療器械國際標準立項申請。
積極推進國際標準制定
我國主導制定的國際標準ISO 8536-15《醫用輸液器第15部分:一次性使用避光輸液器》目前處于最終國際標準草案(FDIS)投票階段;國際標準ISO/DIS 24072《輸液器進氣器件氣溶膠細菌截留試驗方法》和技術規范ISO/TS 24560-1《組織工程醫療產品 軟骨核磁評價 第1部分:采用延遲增強磁共振成像和 T2 Mapping技術的臨床評價方法》已進入國際標準草案(DIS)階段。
積極參與國際標準化活動
組織參加國際標準化會議50余次,及時跟蹤國際標準新動態,代表我國參與國際標準投票共計193次,新推薦16名專家成為國際標準組織注冊專家,積極參與國際標準化活動。
提升標準服務水平
一是按技術領域研究編印《醫療器械標準目錄》,在國家藥監局和國家藥監局醫療器械標準管理中心網站面向社會公開。二是現行333項醫療器械強制性行標文本和871項非采標推薦性行標文本全部公開,提高標準可及性,服務標準各相關方。三是制定并公開醫療器械標準年度宣貫計劃和通知,共組織對123項醫療器械標準進行宣貫培訓。
宣傳推廣標準理念
一是成功舉辦2021年“世界標準日”醫療器械標準化主題宣傳活動。在北京舉辦以“標準助推醫療器械高質量發展”為主題的首屆中國醫療器械標準論壇活動,并組織醫用X射線分標委在深圳舉辦了以“創新科技時代下的醫療器械標準”為主題的第七屆IEC國際醫療器械標準論壇。
二是配合2021年全國醫療器械安全宣傳周,組織舉辦醫療器械標準管理線上分會。解讀最新醫療器械標準規劃政策,講解醫用電氣設備基礎通用安全標準相關要求和實施要點,進一步宣傳標準理念。
三是舉辦醫療器械標準綜合知識培訓班和GB 9706.1—2020免費線上公益培訓班,5300余人參訓,進一步統一認識,加深理解,促進標準順利實施。