醫療器械監管實現六個新 2021監管工作盤點
加入日期:2022/3/2 9:23:56 查看人數: 2051 作者:admin
2021年是黨和國家歷史上具有里程碑意義的一年,也是我國醫療器械監管事業全面進步的一年。監管部門認真貫徹黨中央、國務院重大決策部署,嚴格落實“四個最嚴”要求,新冠肺炎疫情防控產品上市穩步推進,審評審批制度改革持續深化,全生命周期質量監管不斷加強,監管體系和監管能力建設步伐明顯加快,各項工作有序有力推進,“十四五”醫療器械監管工作開局良好。
堅持立法先行
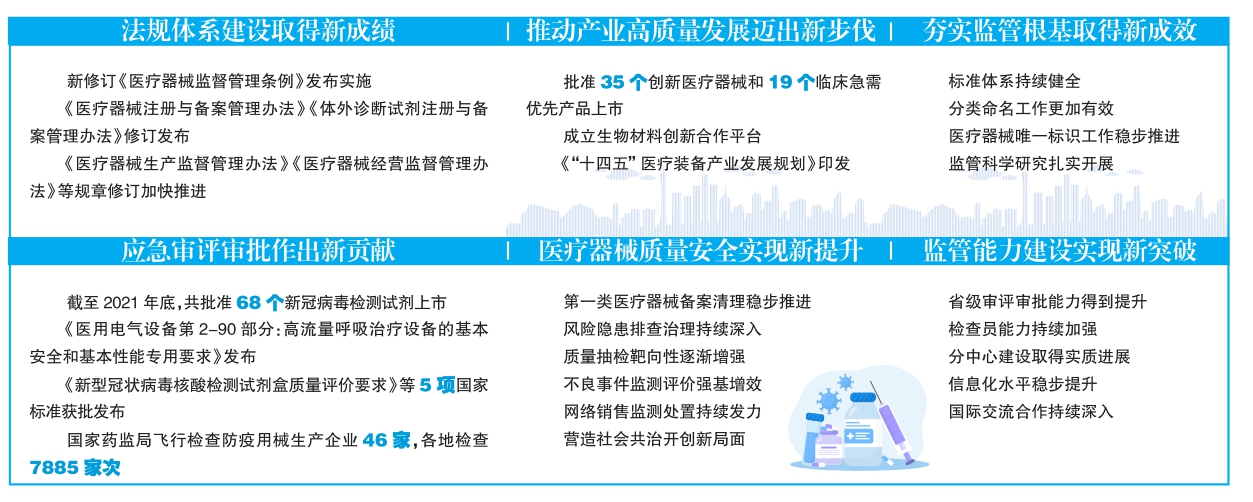
法規體系建設取得新成績
新修訂《醫療器械監督管理條例》(以下簡稱《條例》)發布實施。監管部門堅持改革創新,鞏固拓展審評審批制度改革成果,建立注冊人制度,完善臨床評價要求,推進職業化專業化檢查員隊伍建設,強化全生命周期質量風險監管,加大違法行為處罰力度,醫療器械監管步入法治新階段。同時,全國藥監系統積極組織開展《條例》宣貫,迅速形成學用《條例》的濃厚氛圍。
《條例》配套規章制度逐步完善?!夺t療器械注冊與備案管理辦法》《體外診斷試劑注冊與備案管理辦法》修訂發布,《醫療器械生產監督管理辦法》《醫療器械經營監督管理辦法》等配套規章修訂加快推進。國家藥監局統籌系統資源和力量,成立12個法規制度研究組,圍繞監管實踐中的重點難點熱點問題開展專題研究。
服務疫情防控大局
應急審評審批作出新貢獻
應急審評審批有作為。國家藥監局修訂發布《醫療器械應急審批程序》,保障應急審批及時有序。截至2021年底,共批準68個新冠病毒檢測試劑上市,有效滿足新冠肺炎疫情防控需要。
疫情防控用械標準化工作有突破。我國主導的國際標準《醫用電氣設備第2-90部分:高流量呼吸治療設備的基本安全和基本性能專用要求》由國際標準化組織(ISO)和國際電工委員會(IEC)網站發布,《核酸擴增法檢測新冠病毒質量規范》國際標準獲批立項?!缎滦凸跔畈《竞怂釞z測試劑盒質量評價要求》等5項國家標準獲批發布。組織醫用防護服等國家標準修訂,疫情防控標準支撐及時有力。
疫情防控用械質量安全有保障。各省份開展新冠病毒檢測試劑檢驗能力建設,截至2021年10月,生產企業所在地省級藥監局均具備檢測能力。全國藥監系統對新批準的新冠病毒檢測試劑生產企業實行全覆蓋飛行檢查,常態化檢查新冠病毒檢測試劑生產企業,對新冠病毒檢測試劑產品開展三輪全覆蓋抽檢,確保產品質量安全。2021年,國家藥監局飛行檢查疫情防控用械生產企業46家,各地檢查7885家次,有力保障了疫情防控用械質量安全。
深化改革創新
推動產業高質量發展邁出新步伐
創新審批助力高質量發展。推動審評前移,加大高端產品研發支持力度。全年批準35個創新醫療器械和19個臨床急需優先產品上市。截至2021年底,共批準上市創新醫療器械134個、臨床急需優先產品49個。國家藥監局與工信部聯合啟動人工智能醫療器械創新任務揭榜掛帥,與工信部等部門聯合印發《“十四五”醫療裝備產業發展規劃》;國家藥監局醫療器械技術審評中心(以下簡稱器審中心)聯合21家單位、機構等成立生物材料創新合作平臺。
智慧審評更加高效規范。器審中心首次政府購買服務任務順利完成,績效優秀;持續加強質量管理體系建設,完善立卷審查要求,優化項目智能分配,科學調整審評資質和人員,統一規范審評尺度,各項機制有效運行,審評質量效率不斷提高。
注冊人制度全面實施。系統總結注冊人制度試點經驗,強化政策頂層設計,進一步優化資源配置、激發產業創新活力。上海、江蘇、浙江、安徽三省一市藥監部門建立長三角一體化跨區域監管協作聯動機制。
重點區域改革試點實質性推進。國家藥監局持續支持海南博鰲樂城國際醫療旅游先行區、粵港澳大灣區等重點區域建設。指導海南做好特許醫療器械急需進口工作,產品使用量明顯提高。穩步推進臨床真實世界數據應用試點,積極探索真實世界數據用于產品注冊。組織第二批試點產品審評審批工作,批準第2個采用臨床真實世界數據的“飛秒激光眼科治療系統”上市。
臨床試驗管理不斷強化。國家藥監局組織修訂《醫療器械臨床試驗質量管理規范》,并公開征求意見。指導各省份落實監管責任,加強臨床試驗機構管理,臨床試驗質量不斷提高。
突出風險治理
醫療器械質量安全實現新提升
第一類醫療器械備案清理穩步推進。以醫用冷敷貼產品為重點,全面清理規范第一類醫療器械備案。通過市級市場監管局自查、省級藥監局檢查、國家藥監局抽查、年終考核等方式,持續加大清理規范力度。
風險隱患排查治理持續深入。以疫情防控類醫療器械、集采中選產品、網售醫療器械等九大類產品為重點,開展全面排查,著力消除區域性、系統性風險隱患。藥監部門會同相關部門開展可用于醫療美容醫療器械整治,全面梳理投訴舉報信息,逐一調查處置。國家藥監局組織89家次飛行檢查,責令3家停產整改。
質量抽檢靶向性逐漸增強。緊盯問題企業和產品,國抽以高風險產品為主,省抽以轄區生產產品為主,國抽和省抽分工協作,互為補充。督促地方嚴厲查處不合格產品。
不良事件監測評價強基增效。國家藥監局持續完善醫療器械不良事件監測體系,遴選確定105家監測哨點,提高風險預警和調查處置能力,通過修改說明書、發布警示信息、改進產品設計等,有效降低風險。啟動37個品種重點監測工作。組織對14個省份的36家企業開展不良事件專項檢查。
網絡銷售監測處置持續發力。加強網售監測平臺建設,實現網售違法違規線索監測、研判、移送等功能。持續開展“清網”行動,組織網售企業和第三方平臺檢查。
營造社會共治開創新局面。國家藥監局組織開展全國醫療器械安全宣傳周活動,圍繞建黨百年醫療器械成果、促進創新與高質量發展等進行宣傳。
強化基礎建設
夯實監管根基取得新成效
標準體系持續健全。國家藥監局聯合國家標準化管理委員會印發《關于進一步促進醫療器械標準化工作高質量發展的意見》;會同工信部籌建醫療裝備產業與應用標準化工作組;批準成立臨床評價和醫用高通量測序2個歸口單位。國家藥監局持續實施標準提高計劃,2021年批準79項行業標準制修訂項目,審核發布146項行業標準。對396項強制性標準和62項強制性標準項目全面評估。截至2021年底,現行有效標準1849項,其中國家標準235項、行業標準1614項,標準覆蓋面、系統性進一步提升。
分類命名工作更加有效。國家藥監局制定發布《醫療器械分類目錄動態調整工作程序》,修訂發布《第一類醫療器械產品目錄》,出臺《體外診斷試劑分類規則》,制定重組膠原蛋白和人工智能類產品分類界定指導原則,積極推進可用于醫美醫療器械等關注度高的熱點產品、邊緣產品和藥械組合產品屬性研究。
醫療器械唯一標識工作穩步推進。國家藥監局會同國家衛生健康委員會、國家醫療保障局推進高風險醫療器械唯一標識實施,聯合印發第二批實施公告,積極推進示范單位遴選。完善唯一標識數據庫,截至目前,該數據庫已有121萬條數據。
監管科學研究扎實開展。強化監管科學研究基地和國家藥監局重點實驗室建設,完成中國藥品監管科學行動計劃第一批4個研究項目,制定新工具、新方法、新標準及相關報告35項。遴選第二批7個重點項目。兩批共認定醫療器械重點實驗室29家。
狠抓能力提升
監管能力建設實現新突破
省級審評審批能力得到提升。國家藥監局持續做好法規培訓,強化熱點難點共性問題研究交流,組織2期1000余名基層業務骨干培訓班。依托北京、上海、江蘇、浙江、山東、廣東6省(市)藥監局,建立第二類醫療器械審評實訓基地,按照專業特長統籌開展培訓,10期共培訓近7000人次。器審中心組織10期培訓,覆蓋9000余人次;“器審云課堂”在“學習強國”學習平臺上線,提供法規和審評要點解讀,收錄課程145期,累計播放超過100萬次,社會反響良好。
檢查員能力持續加強。國家藥監局推進檢查實訓基地建設,打造研究、培訓、演練一體的培訓體系。組織2期國家級檢查員培訓;聘任70名國家級檢查員;針對體外診斷試劑、植入性醫療器械生產控制等,舉辦9期專題教育,培訓6285人次,檢查能力和水平持續提升。
分中心建設取得實質進展。落實國家區域發展戰略,順利推進國家藥監局醫療器械技術審評檢查長三角分中心、大灣區分中心組建。建立全覆蓋的審評質量管理體系,實現審評任務統一分配。構建創新產品主動服務機制,加強與申請人溝通交流,有效推動產業創新發展。
信息化水平穩步提升。完成審評審批一體化建設,國家藥監局醫療器械政務服務系統全部納入網上辦事大廳,為全面實施“一網通辦”提供基礎支撐。發放國家藥監局電子證照,截至2021年底,發放醫療器械電子證照8010張。品種檔案系統初步建成,推動大數據匯聚、關聯融通,為監管提供有力支撐。
國際交流合作持續深入。國家藥監局組織參與國際醫療器械監管者論壇(IMDRF)會議,我國牽頭的“上市后臨床隨訪研究”文件獲批發布。積極參與全球醫療器械法規協調會(GHWP),牽頭制定唯一標識指南,開展唯一標識能力建設培訓,獲得好評。成功舉辦第十二屆中國醫療器械監督管理國際會議(CIMDR),吸引國際監管部門、相關國際組織和中外企業代表積極參加,獲得多方點贊。 (本報記者滿雪整理)